Az összefoglaló jellegű munka ismerteti az 1-es típusú diabétesz terén az utóbbi időben bekövetkezett változásokat, és előrevetíti a közeljövőben várható fejlődést a betegség menedzselésében. A közleményből egyértelműen kitűnik, hogy az új inzulinkészítmények és az egyre fejlettebb inzulinbeadási eszközök mellett a legforradalmibb változások a folyamatos glükózmonitorozásban, az inzulinpumpa-kezelésben és a diabétesz-gondozás digitalizációjában következtek be. Kitér a cikk a béta-sejt-regeneráció és -újdonképződés jelenlegi és jövőbeli lehetőségeire is.
Jeles eseményre, az inzulin felfedezésének 100. évfordulójára készül a világ 2022-ben. Felmerül a kérdés: milyen áttörés volt eddig, és milyen várható a jövőben az 1-es típusú diabetes (T1DM) terén? Különösen aktuálissá teszi a kérdést az a tény, hogy a T1DM incidenciája világszerte, így hazánkban is folyamatos növekedést mutat. Az International Diabetes Federation adatai szerint több mint 1 millió 20 évesnél fiatalabb, T1DM-ben szenvedő ember él a Földön, és ha a jelenlegi növekvő tendencia fennmarad, számuk évente 100.000-rel fog növekedni.
Felváltja-e a technológia az immunológiai terápiákat?
A T1DM-et először az 1970-es években sorolták be az autoimmun betegségek közé, a szigetsejtellenes antitestek felfedezésekor. A betegség lehetséges patomechanizmusának feltárása megcsillantotta a reményt a T1DM megelőzésére, illetve a folyamat esetleges visszafordítására. Mintegy 10 évvel később közölték az első eredményeket a ciklosporinnal, ami felvetette annak lehetőségét, hogy immunterápiával feltartóztatható, illetve megfordítható a betegség. Ekkor azt hitték, hogy a T1DM gyógyítása már elérhető közelségben van…
Ezekben az időkben a technológia még alig kapott helyet a diabetológiai ellátásban. Nem volt otthoni vércukor-monitorozás, penek vagy pumpák sem léteztek, nem beszélve a folyamatos cukormonitorozásról vagy a mesterséges hasnyálmirigyről. Azóta nyilvánvalóvá vált, hogy immunterápiával nem vagyunk képesek alapvetően befolyásolni a T1DM lefolyását. Számos kísérlet történt a primer prevencióra (genetikai hajlam van, betegség még nincs), a szekunder prevencióra (az autoimmun folyamat már jelen van, de maga a betegség még nem), illetve a tercier prevencióra (korai betegség, amikor még értékelhető rezerv inzulinkapacitás van jelen), de átütő sikert egyikkel sem tudtak elérni. Az utóbbi években a teplizumab prevenciós vizsgálat nyomán újra visszatért a remény, hogy immunterápiával a T1DM fellépése késleltethetővé válik.
SIKEREK, AMELYEKET ELÉRTÜNK
Új analóg inzulinok kifejlesztése
Az elmúlt években új bázisinzulin-analógok (Degludec, Glargine-300) kerültek a piacra, amelyeknek 24 órán túli hatástartamuk és lapos, csúcsmentes hatásprofiljuk van. Ez segít az éjszakai hipoglykémia elkerülésében, kicsi a variabilitásuk, hatásuk jobban reprodukálható, és ezáltal rugalmasabb alkalmazást tesznek lehetővé. Napjainkban új, ultrahosszú hatástartamú bázisinzulin kifejlesztésén dolgoznak (LAPSInsulin115), amely kedvező farmakodinamikai és farmakokinetikai hatásprofilja révén heti egyszeri adagolással lesz alkalmazható. Számos ultrarapid hatású inzulin is bevezetésre került, illetve bevezetésre vár a posztprandiális vércukorszint kontrollálására. A FIAsp (aszpart inzulin + nikotinamid és L-arginin) a nemzetközi piacon (már Romániában is! – a ref. megjegyzése) elérhető. További ultrarapid hatású inzulinok kifejlesztése és klinikai vizsgálata is zajlik. A nemrégiben engedélyezett ultrarapid hatású lyumjev inzulin különösen az inzulinpumpában tűnik ígéretesnek.
„Okos inzulinok”
A vélhetően az inzulinkezelés következő generációját jelentő glükózreszponzív inzulinrendszerekben az inzulin adagolását endogén feedback (glükózérzékelés) irányítja. A rendszer alkotóelemei a glükózszenzor (a glükózzal történő kémiai/fizikai interakció során módosuló kémiai anyag) és egy inzulinadagoló eszköz.
Alternatív inzulinbejuttatási módok
Minthogy a szubkután inzulinkezelés kényelmetlen, régóta kísérleteznek az inzulin alternatív úton történő bejuttatásával. Az ilyen módszerek közül a tüdőn keresztül történő adagolás kapott kitüntetett figyelmet, mivel ehhez a nagy alveoláris felszívófelület, a gazdag érellátás, a vékony alveolo-kapilláris barrier kedvező anatómiai és fiziológiai körülményeket teremt. Az első inhalációs rendszert (Exubera) követte az Afrezza, valamint a jelenleg vizsgálat alatt álló Dance-501. Bár ezek az eszközök preklinikai modellekben kedvező glükózcsökkentő hatást mutattak, további vizsgálatok szükségesek effektivitásuk és biztonságosságuk bizonyításához. Lehetséges hátrány a változó biohasznosulás a mellékhatások (köhögés) miatt.
A másik lehetséges alternatív mód a nasalis bejuttatás, mivel az orrüregnek viszonylag nagy, bő érellátású, könnyen hozzáférhető felszívófelülete van. Ugyanakkor vannak hátrányai is, melyeket különböző módokon igyekeznek kiküszöbölni. A szájüreg nyálkahártyája is alkalmas az inzulin bejuttatására. Előnye, hogy könnyen hozzáférhető; nagy, érbő felszívófelülete van; viszonylag jó a permeabilitása; kicsi a fehérjebontó aktivitása; és jó a regenerációs készsége.
Nagy reményeket fűztek az inzulin szájon át történő bejuttatásához egyrészt az egyszerűsége miatt, másrészt azért, mert a felszívódott inzulin a portális keringésen keresztül egyenesen a májba jut, és így fiziológiás hatást gyakorolhat a hepatikus glükózprodukcióra. A módszer legnagyobb hátránya, hogy a szájon át bejuttatott inzulin az alacsony gyomor-pH miatt kémiai, illetve enzimatikus lebomlást szenved. Számos módszert alkalmaztak az enterális felvétel elősegítésére permeációfokozók, illetve proteázgátlók hozzáadásával. Sok próbálkozás történt a transzdermális bevitellel is, lévén a bőr nagy, könnyen hozzáférhető felület a felszívódás számára. Hátrányai ennek a beviteli módnak, hogy a bőr rosszul átjárható, s gyakoriak rajta az allergiás reakciók és a bőrirritáció. Ezek kiküszöbölésére kémiai felszívódásfokozókkal, iontoforézissel és mechanikai módszerekkel (szonoforézis) próbálkoztak.
Penek, smart penek („okos tollak”)
A memória funkcióval ellátott penek, mint a HumaPen Memoir (Eli Lilly) és a NovoPen Echo (Novo Nordisk), vagy a pen-kupakok, amelyek jelzik a beadott inzulinadagokat, mint a Timesulin (Patients Pending) és a GoCap (Common Sensing), már elérhetők a nemzetközi és részben a hazai piacon. Az utóbbi években a Bluetooth összeköttetéssel ellátott tollak, mint az InPen (Companion Medical) és az Esysta pen (Emperra Digital Diabetes Care), az USA-ban már forgalomba kerültek. Ezek az okos tollak lehetővé teszik a beadott inzulindózisok nyomon követését és az adatok automatikus továbbítását Bluetooth összeköttetésen keresztül az okostelefonok különböző alkalmazásaira, illetve a felhőbe történő feltöltésen keresztül azok megosztását az egészségügyi személyzettel.
Napjaink legmarkánsabb technológiai fejlődését az egyre újabb inzulinadagolási módok és glükózérzékelő rendszerek fémjelzik.
Inzulinpumpák
Az inzulinpumpák rapid hatású inzulint adagolnak a szubkután szövetbe óránként vagy félóránként változó, előre programozott sebességgel, amit a felhasználó által aktivált, az étkezésekhez adott bólusok egészítenek ki. Az inzulinpumpák többségében az inzulin a tartályból egy vezetéken keresztül jut el a bőr alá bevezetett kanülbe, néhányukban („patch pump”), a pumpa közvetlenül a bőrhöz van rögzítve, így az inzulin az eszközből közvetlenül jut el a kanülbe, ez a megoldás feleslegessé teszi a vezeték használatát. A modern inzulinpumpák számos kiegészítő funkcióval is rendelkeznek, mint pl. a bóluskalkulátor, amelyek segítenek az étkezési vagy a korrekciós bólus meghatározásában. Különböző (egyszerű, késleltetett vagy kombinált) bólusok beadására is lehetőség van, amivel ideális módon lehet befolyásolni a posztprandiális vércukorszintet az elfogyasztott étel glikémiás sajátosságainak megfelelően. Az átmeneti bázis alkalmazására több órán át tartó inzulinigény-csökkenés (sporttevékenység) vagy -növekedés (betegség okozta stressz) esetén kerül sor.
Glükózmonitorozás
A kapillárisból történő glükózmeghatározás, amit a betegek saját életkörülményeik között végezhetnek (home blood glucose monitoring, HBGM), a maga idejében forradalmasította a diabétesz-gondozást, idővel azonban nyilvánvalóvá vált, hogy ezek a mérések csak pillanatfelvételt tükröznek a folyamatosan változó cukorprofilban.
Folyamatos szöveti cukormonitorozás
A folyamatos glükózmonitorozás (continuous glucose monitoring, CGM) új távlatokat nyitott meg a diabétesz menedzselésében. A napjainkban használatos CGM eszközök enzimmel borított elektróda vagy fluoreszcens technika segítségével 1–5 perces intervallumokban mérik az interstitialis glükózkoncentrációt. A leolvasók vagy önálló eszközök, vagy az inzulinpumpához, okostelefonhoz kapcsolódnak, és az eredményeket vagy valós időben („real-time CGM”), vagy igény szerint szkennelve („flash glucose monitoring”) mutatják. Létezik olyan CGM eszköz is, amely az adatokat csupán gyűjti a retrospektív kiértékelés számára (professzionális vagy „vak” CGM). A valós idejű CGM rendszerek meghatározott időközökben automatikusan kijelzik a glükózértékeket, és riasztanak, ha a glükózszint eléri az előzőleg beállított hypo-, illetve hyperglykaemiás határértékeket, vagy ha a cukorszintváltozás sebessége egy kritikus szintet elér. A legtöbb CGM rendszer napi 2-3-szori kalibrációs ujjbegyes vércukormérést kíván meg, de vannak gyárilag kalibrált eszközök is. A szenzorok élettartama 6–14 nap. Magyarországon még nem, de Európa számos országában léteznek hosszabb ideig (30–90 napig) működő implantálható szenzorok is (Eversense, Senseonics Inc.), amelyek beültetése és kivétele egy kis sebészi beavatkozást igényel.
Glükózreszponzív inzulinadagolás
A glükózreszponzív inzulinadagolás első megtestesítője a hipoglikémia viszonylatában az inzulinadagolás automatikus leállítása alacsony cukorszintnél (Medtronic Paradigm Veo, Medtronic Diabetes), illetve ha megjósolható, hogy a cukorszint záros határidőn belül eléri az előre beállított alacsony határértéket (MiniMed 640G inzulinpumpa, Medtronic Diabetes). A mesterséges hasnyálmirigy sokkal bonyolultabb rendszer, amely mind a hipo-, mind a hiperglikémiát kivédi.
A hurok zárása („closed-loop”)
A hurok zárásával megvalósult a mesterséges hasnyálmirigy, amelyben egy kontroll algoritmus automatikusan és folyamatosan módosítja az inzulinadagolást, hogy a cukorszintet a beállított értéken tartsa. Az első hibrid, zárt rendszerű inzulinpumpa (MiniMed 670G pumpa, Medtronic) 2017-ben került az amerikai piacra, majd több európai ország piacára. A hibrid elnevezés azt jelzi, hogy bár az alap inzulinadagolás automatikus, az étkezési bólusokat a felhasználó – gombnyomással – adja be. Időközben még három másik hibrid, zárt rendszerű inzulinpumpa, illetve alkalmazás kapott forgalomba hozatali engedélyt: a Tandem Control-IQ Amerikában és a Diabeloop, illetve CamAPS FX Európában. Zárt körű csoportokban T1DM-től érintett, elkötelezett emberek „csináld magad” keretek között létrehozott inzulinpumpákat használnak (OpenAPS, Loop).
A mesterséges hasnyálmirigy korlátai
A látványos fejlődés mellett a ma elérhető hibrid, zárt rendszerű inzulinpumpának vannak korlátai is: az inzulinfelszívódás késlekedése (még rapid hatású inzulinanalógok használata mellett is) megakadályozza a rendszer teljes automatizálását, a posztprandiális hiperglikémia kivédése érdekében az étkezési bólusok beadásához a felhasználó közreműködése szükséges. A kanül beszúrásának helyein észlelhető lokális elváltozások befolyásolhatják az inzulinadagolást. Megoldást jelenthetne az intraperitoneális inzulininfúzió, amely a szubkután adagolással összehasonlítva csökkentené a „lag time”-ot, és ezáltal javítaná a cukorkontrollt.
Intraperitoneális inzulinadagolás
Az intraperitoneális inzulinadagolás nemcsak az inzulin felszívódását teszi gyorsabbá és kiszámíthatóvá, de jobban megközelíti a fiziológiás helyzetet is, ahogyan a pancreasban termelődő inzulin eljut a májba. Bár az első implantálható inzulinpumpák már közel három évtizede megjelentek, használatuk napjainkban is korlátozott, részben a szövődmények veszélye, illetve a magas költségek miatt.
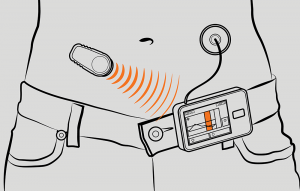 A CGM és az inzulinpumpa egyesítése
A CGM és az inzulinpumpa egyesítése
A jelenlegi rendszerekben két különálló eszközt (a CGM-et és az inzulinpumpát) kell csatlakoztatni a beteg testéhez. A két eszköz kombinálása és méretük csökkentése napirenden van, és jelentősen csökkentené a betegek (elsősorban a kisgyermekek) terheit. A kombinált eszköz kifejlesztését hátráltatja az eltérő viselési időtartam és a szenzor esetleges pontatlansága elsősorban a behelyezést követő első napon.
Bihormonális mesterséges hasnyálmirigy
A kettős hormon adagolású zárt rendszerű inzulinpumpák az inzulin mellett glukagont (vagy egy másik hormont) is tartalmaznak. Glukagont akkor adagol a rendszer, ha hipoglikémia veszélye fenyeget. Megoldandó probléma a glukagon stabilitásának növelése. Kísérletek folynak az inzulin mellett pramlintid és GLP1 adásával is, amelyek a posztprandiális glükózkilengések csökkentésére szolgálnak.
A diabetes-gondozás digitalizációja
Az ún. proximális technológiák (inzulinadagolás és glükózmonitorozás) mellett a kommunikációban, az edukációban, az intervencióban alkalmazható ún. disztális technológiák is fejlődésen mennek keresztül. Ide tartoznak a telemedicina, a mobil alkalmazások, a játék alapú támogatások, a társadalmi platformok és a páciensportálok.
Adatletöltés
Az adatok letöltése az inzulinpumpáról és a CGM eszközről a számítógépre lehetővé teszi az adatok statisztikai értékelését, a minták megjelenítését, pl. „ambulatory glucose profile” formájában. A különböző cégek számos szoftvert bocsátanak rendelkezésre (Medtronic Carelink, Dexcom CLARITY, Abbott CoPilot, Roche Accu-Chek 360, LifeScan OneTouch). Ezek segítségével az egészségügyi személyzet távolról is láthatja a páciens adatait, és nagyobb lehetősége van a terápiás tanácsadásban, mint ha csak a személyes találkozásokra szorítkoznának.
Távmonitorozás
A CGM rendszerek folyamatosan küldik az adatokat a felhőbe, amelyen keresztül pl. a szülők távolról is képesek követni a beteg vércukorszintjének alakulását, sőt riasztást is kapnak a túl magas vagy túl alacsony értékekről a saját okostelefonjukra.
Mobil diabetes-alkalmazások
A mobil egészségügyi alkalmazások, ezen belül a diabétesszel összefüggő alkalmazások egyre népszerűbbek. Több mint 165.000 általános és több mint 1.100 diabétesszel összefüggő mobil alkalmazás (pl. Bant, Glooko, mySugr, One Drop és Tidepool) ismeretes, melyeknek szerepük lehet az anyagcsere-állapot javításában. Elterjedésüknek egyelőre azonban még vannak korlátai: költségek, elérhetőség, tudományos evidenciák, a törvényi szabályozás hiánya. Ezek azonban a közeljövőben legyőzhetők lesznek.
TOVÁBBFEJLESZTÉSI LEHETŐSÉGEK
Döntéstámogató rendszerek
Hagyományosan az inzulinadagolás mikéntjét – pl. a bazális rátát, az inzulin/szénhidrát hányadost, a korrekciós faktort stb. – az egészségügyi személyzet a betegvizitek alkalmával állítja be a vércukornapló, a vércukormérő, illetve az inzulinpumpa adatainak letöltése alapján. Napjainkban számos kutató dolgozik automatizált döntéstámogató rendszerek kifejlesztésén, amelyek algoritmusok segítségével optimalizálják a kezelést.
A fejlett technológiák széles körű elterjedése ellenére a T1DM-ben szenvedő betegek életkilátásai elmaradnak egészséges társaikéitól. Ezért a kutatók folyamatosan kutatják a betegség megelőzése mellett a lehetőséget a progresszió feltartóztatására, a folyamat megfordítására.
A pancreas-transzplantációt már régóta a diabetes-„gyógyítás” eszközének tekintették. Alkalmazását korlátozza a donorhiány és az élethosszig tartó immunszuppresszió, amit a beavatkozás igényel.
Az Edmonton-protokoll 20 évvel ezelőtti bevezetése óta a szervdonorokból izolált szigetek intraportális infúziója elfogadott terápiává vált a világ számos táján. Ez azon az autotranszplantációs megközelítésen alapszik, amit a teljes pancreatectomián átesett betegek esetében alkalmaznak, hogy elkerüljék a „brittle diabetes” kialakulását. A teljes pancreas transzplantációját (ami nagy hasi műtétet igényel) olyan esetekben végzik, amikor a beteg új pancreas mellett veseátültetést is igényel. A donor szervek korlátozott elérhetősége miatt ez a megoldás csak az esetek kis részében alkalmazható. Ez arra ösztönözte a kutatókat, hogy alternatív, korlátlan béta-sejt-forrás után kutassanak.
Mesterséges béta-sejtek előállítása
Az utóbbi években a kutatók figyelme arra irányult, hogy szomatikus sejtekből vagy pluripotens őssejtekből béta-sejteket állítsanak elő. Erre elvileg két lehetőség áll rendelkezésre. Az egyik út, hogy azonos csíralemezből származó sejteket (pl. májsejteket, illetve az exokrin pancreas ductalis sejtjeit) alakítjuk át béta-sejtekké. Ezek az újdonképződött béta-sejtek képesek glükózdependens inzulinszekrécióra, ugyanakkor nem váltanak ki immunreakciót. A másik lehetőség, hogy pluripotens őssejtekből alakítjuk ki béta-sejteket.
Májsejtek átalakítása béta-sejtekké
 Egy ausztrál munkacsoport májsejtekből álló tumoros sejtvonalat genetikailag úgy módosított, hogy a sejtek képesek voltak proinzulint szintetizálni, és a hasítás során keletkezett inzulint a szekrétoros granulumokban tárolni. A májsejtekből történő béta-sejt-képzéshez különböző növekedési és transzkripciós faktorokra van szükség. A sejtvonal transzplantálható volt, és diabeteses egerekbe beültetve normalizálta az állatok vércukorszintjét. Kísérletek folytak Langerhans-sziget-neogenezisre az endokrin differenciációhoz szükséges neurogenin-3 bevitelével virális vektor segítségével. A bevitelt követően periportálisan (a májvéna porta körüli régiójában) sziget-neogenezis indult el.
Egy ausztrál munkacsoport májsejtekből álló tumoros sejtvonalat genetikailag úgy módosított, hogy a sejtek képesek voltak proinzulint szintetizálni, és a hasítás során keletkezett inzulint a szekrétoros granulumokban tárolni. A májsejtekből történő béta-sejt-képzéshez különböző növekedési és transzkripciós faktorokra van szükség. A sejtvonal transzplantálható volt, és diabeteses egerekbe beültetve normalizálta az állatok vércukorszintjét. Kísérletek folytak Langerhans-sziget-neogenezisre az endokrin differenciációhoz szükséges neurogenin-3 bevitelével virális vektor segítségével. A bevitelt követően periportálisan (a májvéna porta körüli régiójában) sziget-neogenezis indult el.
Őssejtek mint béta-sejt-források
Számos vizsgálati protokollt fejlesztettek ki a humán embrionális őssejtek, illetve az indukált pluripotens őssejtek béta-sejtekké történő differenciálódásának elősegítésére. A humán embrionális őssejtekből származó enkapszulált pancreas progenitor sejtekkel folytatott klinikai vizsgálatok 2014-ben kezdődtek, és jelenleg is folynak. A kezdeti eredmények megfelelő immunizolációt, de az elégtelen vaszkularizáció miatt a sejtek csökkent életképességét mutatták. A későbbiekben az eljárást szisztémás immunszuppresszióval kombinálták. A legújabb vizsgálatok képesek voltak C-peptidet detektálni, ami működőképes béta-sejtek jelenlétére utal. Még hosszú utat kell megtenni addig, amíg az enkapszulált őssejtek rutinszerűen alkalmazhatók lesznek a klinikai gyakorlatban.
Immunológiai megfontolások
A beültetett sejtek megvédése az immuntámadástól alapvető kérdés. Az immunrendszer féken tartása immunszuppresszióval (mindaddig, amíg az immuntolerancia megvalósul) szükséges feltétel a szigetsejt-transzplantációban. Az enkapszulált sejtek alkalmazása szükségtelenné teszi az immunszuppressziót, de ez a módszer emberben még nem járt sikerrel. T1DM-ben sajátságos jelenség az autoimmun folyamat újraéledése, amely még akkor is megfigyelhető, ha autológ pluripotens őssejtekből képződnek az új béta-sejtek.
A béta-sejt-pótlás előnyei
Megfelelő nagyságú szigetsejt-massza bejuttatásával allotranszplantáció esetén elérhető, hogy a betegnek inzulinkezelésre ne legyen szüksége. Az inzulinmentesség fenntartása több mint 10 éven keresztül csak kevés esetben érhető el. Ugyanakkor a súlyos hipoglikémia elkerülése több mint 10 éven át az esetek 80%-ában megvalósítható mindaddig, amíg néhány funkcionáló béta-sejt jelen van. A szigetsejt-transzplantáció jótékony hatása szoros összefüggést mutat a béta-sejt-rezervvel. CGM-mel végzett vizsgálatok megmutatták, hogy az euglikémia fenntartásához nagyszámú funkcionáló szigetsejtre van szükség. A glükózvariabilitás csökkentéséhez kisebb, a hipoglikémia kivédésére minimális szigetsejttömeg is elegendő. Így, bár egyes esetekben újra kell kezdeni az inzulinkezelést, a kismértékű endogén glükózfüggő inzulinszekréció előnyei (ami a reziduális C-peptid-produkcióval jellemezhető) nem alábecsülhetők. Korábban kimutatták, hogy a T1DM-betegeknek az a kisebb csoportja, amelynek tagjai értékelhető C-peptid-szekrécióval rendelkeznek, kevésbé hajlamos a súlyos hipoglikémiára, kisebb a glükózvariabilitása, és kevésbé hajlamos a kisér szövődményekre. A súlyos hipoglikémia elkerülése, ami jelenleg a szigetsejt-transzplantáció legfontosabb indikációja, nagy klinikai jelentőséggel bír. A hipoglikémia kivédése és a glükózvariabilitás csökkentése a hipoglikémia észlelésének képességét (,,awareness”) is helyreállítja.
A béta-sejt-pótlás veszélyei
A szigetek intraportális infúziója alapvetően nem invazív beavatkozás. Ritkán vezet vérzéshez vagy a portális véna trombózisához. Az allotranszplantáció legnagyobb hátránya az élethosszig alkalmazandó immunszuppresszió, az ezzel kapcsolatos infekció- és neopláziaveszély. Az opportunista kórokozókkal (citomegalovirus, Epstein-Barr-vírus és Pneumocystis jirovecii) való megfertőződés megfelelő profilaxissal kivédhető. Szigetsejt-transzplantációt követően különböző bőrrákok mellett a poszttranszplantációs limfoproliferatív betegség fellépésével is számolni kell, amelynek előfordulási gyakorisága (1%) megegyezik a többi szolid szerv transzplantációja kapcsán tapasztalt gyakorisággal. A nefrotoxicitás is rontja a betegek életkilátásait, különösen beszűkült vesefunkció esetén kell nagyon óvatosnak lenni. Ezeknek a problémáknak egy részét kiküszöböli az alternatív béta-sejt-források alkalmazása. A makro-, illetve mikro-enkapszulációs technika feleslegessé teszi az immunszuppresszió alkalmazását, szubkután implantáció esetén nem kell számolni a portális véna trombózisával.
ZÁRÓ GONDOLATOK
A T1DM klinikai diagnózisa napjainkban a legtöbb országban a kórtörténeten alapszik, és a vércukorméréssel, illetve a keringő szigetsejtellenes antitestek kimutatásával nyer igazolást. Ezt követően a beteget (szülőt) tájékoztatják arról, hogy az egyetlen terápiás lehetőség az egész életen át tartó exogén inzulinnal történő kezelés. Bár az inzulinkészítmények és az inzulinadás módjai az elmúlt évtizedekben jelentős fejlődésen mentek keresztül, átütő változás alig érzékelhető azóta, hogy Banting és Best közel 100 évvel ezelőtt felfedezték, hogyan lehet kivonni az inzulint a pancreasból. A kezelésben progresszió akkor várható, ha többet tudunk meg a T1DM-ben bekövetkező béta-sejt-diszfunkcióról és fokozatos béta-sejt-vesztésről.
Nagyon valószínűnek tűnik, hogy a T1DM nem homogén betegség, és a különböző alcsoportoknak különböző a kialakulási mechanizmusa. Így elképzelhető, hogy a különböző patogenezisű alcsoportok a jövőben eltérő terápiát igényelnek majd.
Nyilatkozat
A szerző a cikk megírása, illetve a kutatómunka során anyagi támogatásban nem részesült, a cikk témájával kapcsolatos érdekeltsége nincs.
(Forrás: Dr. Körner Anna, OTSZ online, 2021. április 27.)
Megjelent: DiabFórum magazin 2020/2 – május (4-8. oldal)
Borítókép: designed by Romanzaiets – Freepik.com